SK바이오사이언스사 개발·제조 ‘스카이코비원멀티주’ 중앙약사심의 통과
‘국내개발 1호’ 코로나19 백신이 중앙약사심의위원회를 통과했다.
중앙약사심의위원회 오일환 위원장은 27일 “SK바이오사이언스사의 ‘스카이코비원멀티주’(개발명, GBP510)를 품목허가할 수 있다고 의견을 모았다”고 밝혔다.
이날 코로나19 백신 중앙약사심의위원회 자문 결과 브리핑에 나선 오 위원장은 “스카이코비원멀티주의 안전성과 효과성에 대해 자문하기 위해서 중앙약사심의위원회를 지난 26일 개최했다”면서 이같이 말했다.
오 위원장은 이어 “현재까지 임상시험에서 발생한 이상사례 등의 안전성은 허용할 수 있는 수준으로 판단했다”면서 “효과성 면에서도 품목허가가 가능하다고 판단했다”고 덧붙였다.
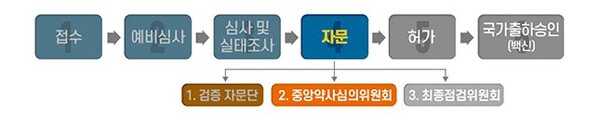
이에 따라 식품의약품안전처는 향후 전문가 의견과 효능·효과(안), 용법·용량(안), 권고사항 등을 종합적으로 판단한 후 가능한 이번 달 내로 최종점검위원회를 개최, 허가 여부를 최종결정할 것으로 보인다.
중앙약사심의위원회의 ‘스카이코비원멀티주’에 대한 임상시험 자료 등에 대한 자문 결과 기존에 허가한 백스제브리아주와 비교한 면역원성 임상결과를 토대로 국내 코로나19 예방 목적에서 필요성이 인정되고, 코로나19 백신 안전성·효과성 검증 자문단의 자문 결과를 종합할 때 품목허가할 수 있을 것으로 판단했다.
또한 임상시험에서 발생한 이상사례 등 안전성은 허용할 수 있는 수준으로 봤다.
다만 국소 및 전신에서 예측되는 이상반응은 1차 접종 시 이에 대한 안내가 필요하다는 의견을 내놨다.
백신 투여와 관련성이 있는 예측되지 않은 이상사례는 백신군의 약 13.3%에서 발생했는데, 주요 증상은 주사부위소양증, 어지러움, 통증 등이었다. 그러나 대조군은 약 14.6%에서 발생해 차이는 없었다.

‘중대한 이상사례’는 백신군 0.5%와 대조군 0.5%(5명, 9건)로 유사했다. 백신 투여와 관련성을 배제할 수 없는 ‘중대한 약물이상반응’은 급속 진행성 사구체신염 1건이 있었지만 임상시험 자료 제출 시점에는 회복 중이었다.
효과성과 관련해 기존에 허가된 백스제브리아주를 대조 백신으로 비교한 면역원성 결과에서 18세 이상 4주 간격 2회 투여 14일 후 중화항체가는 2.93배 형성됐다.
혈청전환율은 백신군 98.06%와 대조군 87.30%로 백신군에서 10.76% 높게 확인되어 허가를 위한 면역원성 결과는 인정가능하다고 판단했다. 아울러 허가 후 백신 예방효과 자료를 제출하도록 권고했다.
한편 전반적인 안전성 확보방안은 적절하며, 허가 후 ‘위해성관리계획’으로 기존 백신과 유사하게 특별관심 대상 이상사례를 추가해 관찰하고 평가하는 것이 타당하다는 의견을 밝혔다.
이상의 중앙약사심의위원회의 의견을 종합할 때, 에스케이바이오사이언스社의 ‘스카이코비원멀티주’를 품목허가할 수 있다고 의견을 모았다.
식약처 서경원 식품의약품안전평가원장은 “이 제품은 식약처가 세계 최초로 허가 심사를 하는 코로나19 백신으로, 원료에서 완제품까지 국내에서 생산되는 최초의 국내 개발 코로나19 백신”이라고 설명했다.
서 원장은 이어 “글로벌 공급 등을 고려해 WHO 긴급사용승인을 목표로 하고 있다”면서 “이번 심사 과정에서의 전문성과 객관성을 확보하고자 다양한 분야의 권위 있는 전문가 의견을 폭넓게 수렴했다”고 덧붙였다.

